Auxilius Pharma, polsko-amerykański startup, działa na co dzień w branży biotechnologicznej. Głównym celem spółki jest zarejestrowanie leku na dusznicę bolesną w Stanach. w tej chwili realizowane są pierwsze badania kliniczne fazy I, a w tle jest pozyskanie kolejnego finansowania oraz ewentualne plany giełdowe.
O tym jak udało się założyć startup biotechnologiczny, pozyskać niezbędne finansowanie i jak wygląda „od kuchni” prowadzenie spółki w modelu Virtual Biotech oraz badania kliniczne, rozmawialiśmy z Jędrzejem Litwiniukiem, założycielem Auxilius Pharma.
Natalia Kieszek: Ma Pan ogromne doświadczenie w branży finansowej oraz medycznej. Jakiś czas temu zdecydował się Pan na przeprowadzkę do Stanów, dlaczego?
Jędrzej Litwiniuk, prezes Auxilius Pharma: Moja historia ze Stanami Zjednoczonymi rozpoczęła się zdecydowanie wcześniej. Już jako nastolatek spędziłem tutaj kilka lat ucząc się w liceum. Później wróciłem do Polski i po kilkunastu latach stwierdziłem, iż czas na powrót do Stanów.
Zdecydowałem się zrobić program Executive Master of Health Administration na Columbia University w Nowym Jorku. Był to dobry sposób, aby przybliżyć się do rynku amerykańskiego i zrozumieć jego specyfikę. Na początku studiów założyłem z kolegą pierwszy startup farmaceutyczny, w którym działałem przez rok.
Następnie poznałem dra Uwe Tigöra, z którym pod koniec studiów w 2019 roku założyliśmy Auxilius Pharma. Od początku interesował nas rynek amerykański. Dlatego uznałem, iż będąc tutaj na miejscu, będzie mi łatwiej rozwijać działalność firmy. Mieszkam niedaleko Bostonu, gdzie znajduje się ogromna ilość firm z naszej branży, mam również dużo większy dostęp do wielu specjalistycznych konferencji. Dlatego w obliczu decyzji o założeniu Auxilius Pharma, pozostanie w Stanach było czymś naturalnym.
Z czego wynikała decyzja o założeniu firmy? Czy to zdobyte doświadczenie, czy może dojrzałość rynku skłoniła Pana do tego?
O założeniu spółki biofarmaceutycznej zacząłem myśleć już dawna, kiedy pracowałem jeszcze w Polsce w funduszu Enterprise Investors, gdzie zajmowałem się sektorem medycznym. Zrozumiałem wtedy, iż rozwój leków jest biznesem o ogromnym, globalnym potencjale, podczas gdy inne usługi medyczne czy diagnostyczne pozostają raczej w lokalnym zasięgu rynkowym.
Warto przeczytać: Prowadzenie własnego biznesu jest wyzwaniem. Często jest się wyrzucanym ze strefy komfortu – rozmowa z Aliną Sztoch, CEO i Co-founderką marki Kubota
Dlaczego Auxilius Pharma zarejestrowano jednak w Polsce?
Zakładając spółkę nie posiadaliśmy odpowiedniego finansowania, a koszty miały dla nas ogromne znaczenie. Rejestracja i prowadzenie spółki w Polsce jest zdecydowanie tańsze niż w USA, dlatego zdecydowaliśmy się na taki krok. Warto też podkreślić, iż pierwsze finansowanie pozyskiwaliśmy od osób fizycznych właśnie z Polski, dlatego dla nich to też było ułatwienie, np. pod względem podatkowym, czuli się bardziej komfortowo inwestując w polską spółkę. przez cały czas nasze finansowanie w głównej mierze pochodzi od polskich inwestorów.
Natomiast na rynku amerykańskim poszukujemy partnerów farmaceutycznych. Po ponad czterech latach działalności wchodzimy w najważniejszy moment, czyli badanie kliniczne I fazy. To etap, w którym firmy farmaceutyczne zaczynają interesować się naszym projektem. Planujemy podpisać umowę partneringową i rozwijać nasz flagowy projekt we współpracy z większym graczem. Mogę zdradzić, iż prowadzimy już rozmowy w tej sprawie.
Auxilius Pharma stawia na model Virtual Biotech. Jak od kuchni wygląda działalność w takim modelu?
Nie posiadamy własnego laboratorium, czy zakładu wytwarzania. Na ten moment trzymamy się tego modelu, chociaż nie wykluczamy w przyszłości założenia swojego niewielkiego labu. Od początku uważaliśmy, iż naszą główną kompetencją jest selekcja projektów lekowych o odpowiednim potencjale, wyznaczenie optymalnej ścieżki regulacyjnej i skuteczny oraz efektywny kosztowo rozwój leku. Obecnie współpracujemy blisko z ponad 10 osobami. Niektóre z nich pracują na pełen etat, niektóre zaś wykonują określone zlecenia. Jest to dla nas bardzo wygodny model, gdyż na kolejnych etapach rozwoju leku potrzebujemy różnych specjalistów.
Model Virtual Biotech pozwala nam ograniczyć nie tylko koszty stałe, ale również daje nam dużo większą elastyczność i efektywność w działaniu. Współpracujemy z ekspertami m.in. ze Stanów oraz Kanady, którzy mają na swoim koncie ogromne doświadczenie w rejestracji leków w USA i bardzo precyzyjnie znają wymogi FDA (przyp. red. Agencja Żywności i Leków).
Prowadzenie biznesu w tym modelu nie jest typowe na polskim rynku, w odróżnieniu od Stanów. Może to być spowodowane faktem, iż w Polsce popularnością cieszą się programy grantowe, które premiują posiadanie infrastruktury i stałych miejsc pracy. W naszym modelu koncentrujemy się na optymalnym rozwoju projektów, przy zachowaniu minimum kosztów stałych. Pozwoliło nam to od samego początku osiągnąć wysoką efektywność kosztową. Jestem pewien, iż duża firma farmaceutyczna wydałaby nieporównanie więcej niż my, żeby doprowadzić projekt do Fazy 1. Nie ponosimy kosztów związanych z utrzymaniem dużego zespołu, czy infrastruktury, a dodam, iż w USA czy Kanadzie eksperci z obszaru farmaceutycznego zarabiają bardzo dużo. Nakłady finansowe związane są przede wszystkim ze zlecaniem prac B+R firmom zewnętrznym. Jestem pewny, iż coraz więcej spółek i inwestorów, również na rynku polskim, będzie dostrzegać atuty i potencjał modelu Virtual Biotech.
Wasz flagowy projekt to AUX-001, czyli lek kardiologiczny na dusznicę bolesną. Wyjaśnijmy najpierw czym jest dusznica i ile osób ona dotyka na świecie?
Dusznica bolesna dotyka około 3% populacji w krajach rozwiniętych. Jest to objaw choroby wieńcowej, która dotyczy jeszcze szerszej grupy ludzi. Skala potrzeby medycznej zwiększa się ze względu na proces starzenia się oraz niezdrowy styl życia i odżywiania społeczeństw, szczególnie zachodnich. Nieodpowiednio kontrolowana dusznica jest chorobą, która obniża mocno jakość życia, powodując np. iż pacjenci rezygnują z wysiłku fizycznego bądź pracy zawodowej.
Mimo iż znaczna część innowacji pochodzi z USA, znaleźliśmy się w sytuacji, w której w Europie jest zdecydowanie więcej dostępnych leków na dusznicę bolesną w porównaniu do USA. W Stanach Zjednoczonych, które są dla nas strategicznym rynkiem, choroba ta w pewnym sensie stała się zapomnianym obszarem – od kilkunastu lat nie pojawił się tam żaden nowy lek w tym obszarze, większość dostępnych terapii ma ponad 20-30 lat. Wynika to m.in. z trwającego w ostatnich dekadach przekonania, iż metody inwazyjne, jak angioplastyka, rozwiązują problem dusznicy bolesnej. Jednak w tej chwili wiemy już, każdy taki zabieg wiąże się z ryzykiem dla pacjenta, nie gwarantując zniknięcia objawów dusznicy i oznacza bardzo wysokie koszty zabiegu i hospitalizacji. Amerykańscy ubezpieczyciele medyczni dostrzegają już ten problem.
Znaczna grupa pacjentów nie odpowiada na leczenie dusznicy bolesnej, przez co mamy do czynienia z niezaspokojoną potrzebą medyczną. Uważamy, iż amerykańscy pacjenci będą zainteresowani wypróbowaniem leku o innym mechanizmie działania, dotychczas niedostępnym w Stanach, a jednocześnie sprawdzonym na licznych rynkach europejskich, czy azjatyckich. Opracowujemy ulepszoną jego formułę, dzięki czemu możemy liczyć na wyższą od oryginału skuteczność i wygodę przyjmowania leku.
Celem Auxilius Pharma jest uzyskanie zgody na wprowadzenie leku do obrotu na rynku amerykańskim. Jak mają wyglądać jego badania kliniczne?
Będą one dużo krótsze i tańsze niż w przypadku leków innowacyjnych. Wspólnie z FDA uzgodniliśmy w zeszłym roku, iż oprzemy się na tzw. „ścieżce 505(b)2”, dedykowanej wprowadzaniu na rynek przebadanych wcześniej, a następnie ulepszonych leków. FDA uznaje, iż w takiej sytuacji nie ma potrzeby wykonywania wszystkich badań od początku, i wykazywania, iż lek jest bezpieczny i skuteczny. „Ulepszenie” leku można rozumieć np. jako zmianę modelu dawkowania, czy sposobu podania, np. z dożylnego na doustny. My zajmujemy się zmianą częstotliwości dawkowania, gdyż do tej pory nasz lek referencyjny trzeba było przyjmować dwa razy dziennie, a my opracowaliśmy wersję, którą pacjent przyjmuje jeden raz w ciągu doby.
Ustaliliśmy z FDA, iż aby uzyskać dopuszczenie do obrotu w USA, musimy wykazać, iż nasz lek jest biorównoważny do tego, który jest już dostępny w Europie. W praktyce oznacza to, iż musimy wykonać uproszczone badanie kliniczne fazy I, następnie możemy pominąć fazę II, a na koniec musimy zrobić jedno badanie fazy III i wykazać, iż AUX-001 jest lepszy od placebo. Badanie ograniczy się do próby wysiłkowej. Wszystko to oznacza, iż badania kliniczne AUX-001 będą nieporównywalnie krótsze i tańsze niż w przypadku innowacyjnych terapii.
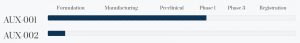
W takim razie ile będą trwać badania kliniczne i kiedy można spodziewać się decyzji FDA?
Dla nowych cząsteczek, cykl rozwoju od pierwszych prac przedklinicznych do dopuszczenia do obrotu trwa klasycznie około 15 lat. W naszym przypadku będzie to zdecydowanie krótsza perspektywa. Nasz harmonogram zakłada złożenie wniosku o dopuszczenie leku do obrotu na amerykańskim rynku jeszcze w 2026 roku.
Ile do tej pory pozyskaliście kapitału od inwestorów i czy będzie Wam potrzebna kolejna runda finansowania?
Do tej pory zebraliśmy około 10 mln zł. Początkowo były to środki od osób indywidualnych, natomiast w ubiegłym roku pojawiły się dwa fundusze venture capital: Co-founder Zone oraz Augebit FIZ. Obecnie zaczynamy kolejną rundę inwestycyjną, a w perspektywie 12-24 miesięcy rozważamy ścieżkę giełdową. Wiele osób twierdzi, iż możemy się bardzo pozytywnie wyróżnić na polskim rynku publicznym.
Już dziś koncentrujemy się na doprowadzeniu do umowy partneringowej. Zakładamy, iż pozyskamy takiego partnera może już w 2024 roku, i od tej pory przejmie on finansowanie dalszych badań.
Od kilku miesięcy prowadzimy rozmowy z potencjalnymi partnerami w Stanach, mimo iż nie pokazywaliśmy naszego projektu szeroko na rynku. W grudniu wystartowaliśmy z pierwszym badaniem fazy I, w trakcie którego podajemy lek grupie ochotników, aby zobaczyć jak wygląda jego stężenie we krwi. Widzimy, iż firmy mające doświadczenie w tym segmencie rynku są zainteresowane naszym projektem.
Jeśli uda nam się ten plan zrealizować, za dwa lata nasz pipeline może się składać z rozwijanego z partnerem AUX-001, będącego w III fazie badań klinicznych i dwóch projektów we wcześniejszych fazach. Kiedy AUX-001 wejdzie do sprzedaży, nie będziemy potrzebowali już wsparcia inwestorów. Trafia do nas wiele opinii mówiących o tym, iż to bardzo interesujący profil z punktu widzenia polskiego rynku kapitałowego.
Pracujecie nad drugim projektem, jednak nie zdradzacie szczegółów. Proszę powiedzieć, czy zamierzacie pozostać przy leku kardiologicznym, czy może pójdziecie w zupełnie innym kierunku?
Zdecydowanie pozostaniemy w obszarze kardiologicznym. W ubiegłym roku poświęciliśmy bardzo dużo czasu w analizę projektów z różnych obszarów terapeutycznych. Jednak każdy z nich wymagałby od nas stworzenia od podstaw nowego zespołu. Zajmując się projektem lekowym, należy być w tym zakresie absolutnym ekspertem. Dlatego podjęliśmy decyzję, aby w najbliższych latach pozostać przy kardiologii. Zidentyfikowaliśmy już kilka ciekawych projektów w tym obszarze, właśnie w strategii zmniejszania częstotliwości dawki. Pierwszy z nich możemy uruchamiać adekwatnie już dziś, kiedy tylko uda nam się pozyskać finansowanie.
W mediach nazywają Auxilius Pharma polsko-amerykańskim startupem. Czy zgadza się Pan z tym określeniem?
W pełni zgadzam się z określeniem, iż jesteśmy polsko-amerykańską organizacją, obecną na tych dwóch rynkach. Formalnie jesteśmy polską firmą, natomiast strona technologiczna i biznesowa rozwijana jest po obu stronach Atlantyku. Myślę, iż Auxilius Pharma znajduje się w zwrotnym punkcie, ponieważ rozpoczęcie badań klinicznych jest momentem dojrzałości dla spółek z naszej branży. Wchodzi się w etap, gdzie pojawiają się regulacje, musimy trzymać się standardów jakości. Dlatego uważam, iż właśnie kończymy startupowy etap.
Rejestracja leku w USA będzie dla spółki ogromnym kamieniem milowym. Jakie wyzwania jeszcze przed Wami stoją?
Rejestracja leku w USA to perspektywa 2026-2027 roku. W krótkim terminie koncentrujemy się na zapewnieniu finansowania. Nasz projekt może rozwijać się szybko, pod warunkiem, iż będziemy dysponowali odpowiednim kapitałem. W 2024 roku musimy oprzeć się na inwestorach, ale w tym czasie liczymy na pozyskanie jakościowego partnera biznesowego, który potwierdzi naszą wiarygodność, przejmie na siebie koszty dalszego rozwoju AUX-001 i wesprze w prowadzeniu tych prac. Skupiamy się dziś w pełni na realizacji tego planu.

 1 rok temu
1 rok temu









![Dynamika wzrostu zatrudnienia obcokrajowców [Komentarz]](https://g.infor.pl/p/_files/38930000/rozmowa-o-prace-zatrudnianie-praca-rekrutacja-38929530.jpg)
